2024年2月26日,美国食品药品监督管理局(FDA)授予拜耳的靶向新药BAY 2927088突破性疗法的认定,用于治疗携带人表皮生长因子受体2(HER2/ ERBB2)激活突变,且既往接受过系统治疗的、不可切除或转移性非小细胞肺癌(NSCLC)成年患者。
肺癌是全世界癌症相关死亡的主要原因,非小细胞肺癌是最常见的肺癌类型,占85%以上。在晚期NSCLC患者中,有2%-4%的患者存在HER2激活突变。HER2突变患者对传统化疗的应答均不理想,非选择性酪氨酸激酶抑制剂(TKIs)、曲妥珠单抗联合化疗等方案均收效不佳,因此这类患者亟待有效的靶向治疗策略。
目前,全球仅有一款靶向HER2的ADC药物T-DXd,获得FDA批准用于既往接受过治疗的转移性或晚期携带HER2激活突变NSCLC患者。在国内还未有相关药物获得批准上市。
关于BAY 2927088
BAY 2927088是一种口服可逆酪氨酸激酶小分子抑制剂,可有效抑制HER2突变,包括HER2外显子20插入(HER2 ex20ins)和HER2点突变,以及对突变型表皮生长因子受体(EGFR)相较野生型具有高选择性。
此次突破性疗法的认定是基于一项I期、开放标签、多中心首次人体研究(NCT05099172)的初步临床证据,该研究评估了BAY 2927088在携带HER2或EGFR突变晚期NSCLC成年患者中的安全性、药代动力学和初步疗效。
该项研究在16个国家77个地区开展,数据截止日期为 2023年8月18日,共有76名患者在剂量递增/回填阶段接受了治疗,并进行安全性评估。其中 26.3% 的患者携带突变,73.7% 的患者携带其它HER2或EGFR突变。
该研究的主要终点是安全性、耐受性、药代动力学和最大耐受剂量,次要终点包括研究者评估的ORR和II期推荐剂量(RP2D)。
有效性
拜耳在2023年欧洲肿瘤内科学会(ESMO)大会上披露了该研究的剂量递增和回填部分的早期疗效和安全性数据。数据显示BAY 2927088对携带HER2或EGFR基因突变的NSCLC患者具有较好疗效,特别是在HER2 ex20ins型NSCLC患者中疗效优异,并且具有可控的安全性。
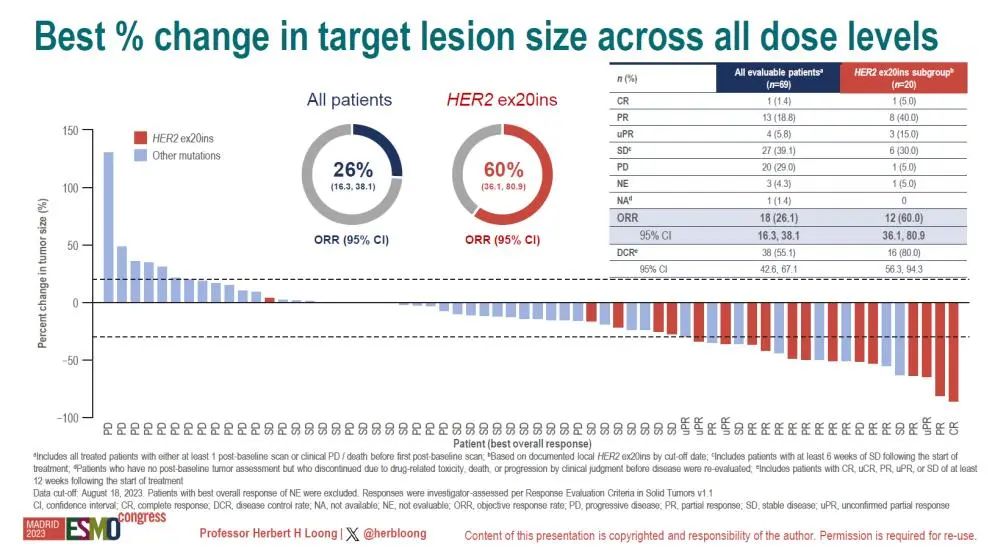
在所有患者中整体客观缓解率(ORR)为26.1%(95% CI,16.3%-38.1%),其中1名患者获得完全缓解(CR),13名患者获得部分缓解(PR),1名患者获得部分缓解(待确认)。39.1%的患者病情获得了稳定(SD),29.0%的患者经历了疾病进展(PD)。整体人群的疾病控制率(DCR)为55.1%(95% CI,42.6%-67.1%)。
在HER2 ex20ins型NSCLC患者(n = 20)中:ORR为60.0%(95% CI,36.1%-80.9%),30.0%的患者SD,5.0%的患者PD,DCR为80.0%(95% CI,56.3%-94.3%)。
安全性
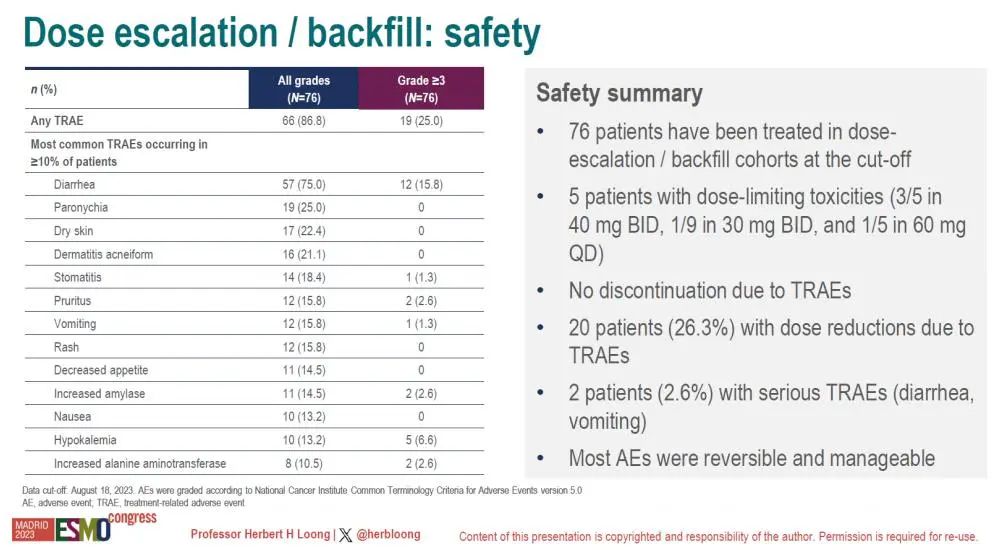
共有5例患者报告了剂量限制性毒性(DLT),其中3名患者的用药剂量为40mg BID,1名患者的剂量为30mg BID,1名患者的剂量为60mg QD。
整体而言,87%的患者发生与药物相关的任何级别治疗相关不良反应(TRAEs),25%的患者发生3-4级TEAEs,没有患者由于药物相关TEAEs而中断治疗。最常见的药物相关TEAEs是腹泻(75%,主要是1-2级)、甲沟炎(25%)和皮肤干燥(22%)。大多数不良反应是可逆且可控的,只有 2.6% 的患者经历了严重的TRAEs(腹泻、呕吐)。
早期的临床证据表明,BAY 2927088有很大潜力使携带HER2基因突变、在先前的全身性治疗中疾病进展的晚期NSCLC患者获益。BAY 2927088此次获得突破性疗法认定,对于具有HER2基因突变的肺癌患者的创新治疗而言,具有里程碑式的意义。
早期的临床证据表明,BAY 2927088有很大潜力使携带HER2基因突变、在先前的全身性治疗中疾病进展的晚期NSCLC患者获益。BAY 2927088此次获得突破性疗法认定,对于具有HER2基因突变的肺癌患者的创新治疗而言,具有里程碑式的意义。
目前剂量扩展仍在进行中,纳入未接受过系统性治疗的HER2激活突变NSCLC患者及既往标准治疗失败的HER2 激活突变NSCLC患者,欢迎报名咨询。
*声明:本文旨在科普肿瘤医学和新药进展,任何重大医疗决策请前往正规医疗机构就诊。
*版权申明:如需转载请联系小编
在线报名