近日,益方生物自主研发的KRAS G12C抑制剂D-1553(Garsorasib)最新I期临床研究结果发表于国际知名的肿瘤学权威期刊《Journal of Thoracic Oncology》(JTO)。研究结果显示,D-1553在携带KRAS G12C突变的非小细胞肺癌(NSCLC)患者中具有良好的安全性和抗肿瘤活性。并已于2022年6月10日被国家药监局药品审评中心纳入突破性治疗药物。
前不久,美国FDA批准口服KRAS G12C抑制剂adagrasib(MRTX849)上市,用于治疗至少接受过一种先前全身性疗法的KRAS G12C突变NSCLC患者。这是继Lumakras(sotorasib)之后全球上市的第2款KRAS G12C抑制剂。此前,该产品获FDA授予突破性疗法资格认定。
2022年12月8日,加科思自主研发的KARS G12C变构抑制剂JAB-21822片被CDE纳入“拟突破性治疗品种”认定,用于治疗既往接受过至少一种系统性治疗(至多不超过三线治疗)的携带KRAS p.G12C突变的局部晚期或转移性NSCLC患者。
大约30%的肿瘤患者都存在KRAS突变,其中包括90%的胰腺癌、50%的结肠癌和25%的肺癌,最常见的突变位点是第12、13和61位密码子,其中以第12位密码子的突变最为常见。在中国人群KRAS G12C的突变频率在非小细胞肺癌约2-5%,结直肠癌约2.5%。这一突变类型治疗比较困难,对许多常用的治疗方案并不敏感,总体预后较差。
KRAS G12C抑制剂捷报频传,为患者带来更多选择和更长生存获益!
D-1553是国内首个自主研发并进入临床试验阶段的 KRAS G12C 抑制剂,也是国内目前公布的临床数据最多,随访时间最长的一款KRAS 抑制剂。D-1553通过共价结合,不可逆地抑制KRAS G12C,使之处于无活性的GDP结合状态。
一项评估D-1553(Garsorasib)在KRAS G12C突变的NSCLC患者中的安全性、耐受性、药代动力学和有效性的I/II期研究截至2022年9月12日(数据截止日),研究共纳入79位NSCLC患者。

截至2022年9月12日,在74例可评估患者中,30例患者评估为部分缓解(PR),38例为疾病稳定(SD),确认的客观缓解率(ORR)为40.5%,疾病控制率(DCR)为91.9%。在接受RP2D(600 mg BID)剂量的62例可评估患者中也观察到了类似的疗效, ORR和DCR分别为38.7%和90.3%,表现出了与FDA批准上市的sotorasib和adagrasib相似的有效性。在早期研究中和患者生存相关的临床终点无进展生存期(PFS)上,D-1553表现突出,达到8.2个月,超过了sotorasib既往报道的6.8个月的水平。此外,D-1553还展现了治疗NSCLC脑转移患者的潜力,在6例基线稳定的脑转移患者中,ORR和DCR分别为17%和100%。
截至2022年9月12日,在接受治疗的79例患者中,75例患者(94.9%)报告了治疗相关不良事件,30例(38.0%)报告了3级或4级不良事件。大多数3或4级的不良反应可控可管理,仅有1例患者因为不良事件永久停药。在所有剂量水平下D-1553的耐受性佳,显示出良好的安全性。
D-1553在前期批露的数据中持续展现了良好的耐受性和令人期待的抗肿瘤活性,随着随访时间的增加,D-1553有望为患者实现更高的临床获益,成为中国患者人群中极具潜力的新选择。
Adagrasib是一款具有高度特异性的口服KRAS G12C抑制剂,经过优化设计具有持久的靶点抑制能力。Adagrasib具有长达24小时的半衰期和广泛的组织分布,而且能够穿过血脑屏障,有助于最大限度地发挥药物效力。
Adagrasib获批,是基于一项多队列KRYSTAL-1试验的最新临床数据。
在KRYSTAL-1试验研究队列A中,116名先前接受过铂类化疗和抗PD-1/L1治疗的NSCLC患者每天两次口服600mg Adagrasib。
中位随访12.9个月,可评估疗效的112例患者客观缓解率(ORR)为43%,其中包括1例完全缓解(CR:1%)和47例部分缓解(PR:42%)。有41名患者疾病稳定(SD:37%),6名患者疾病进展(PD:5%)。疾病控制率(DCR)为80%。接近80%的患者肿瘤都有不同程度的缩小,甚至完全消失。
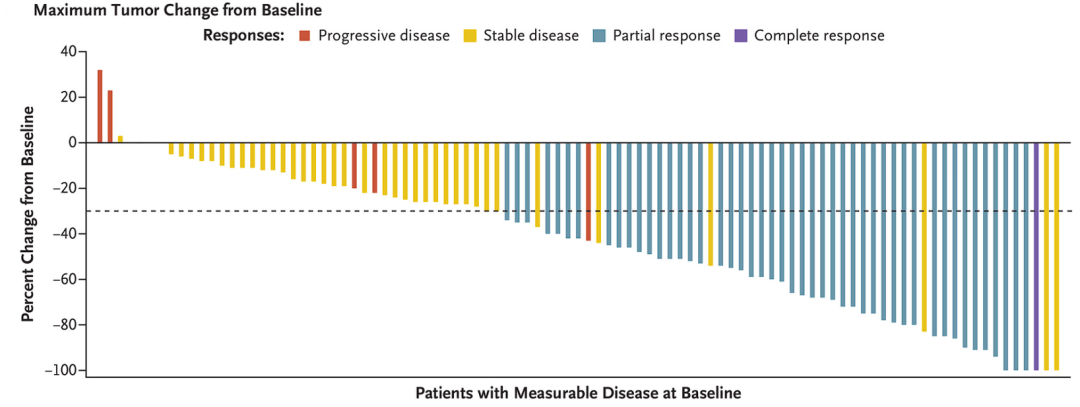
中位缓解持续时间(DoR)为8.5个月。数据截止时,有一半应答者(n=24)正在进行治疗,33%(n=16)的患者保持治疗反应。
中位无进展生存期(PFS)为6.5个月,6个月和12个月PFS率分别为52%和29%。
中位总生存期(OS)为12.6个月,6个月和12个月OS率分别为71%和51%。
研究人员进一步评估了Adgrasib在稳定CNS转移的经治患者的疗效。颅内ORR为33%,其中包括5例CR(15%)和6例PR(18%),17例SD(52%)。DCR为85%。中位颅内PFS为5.4个月,中位颅内病灶缓解时间可达11.2个月,Adagrasib对脑转移患者同样有效。
与既往研究一致,未观察到新的安全信号。113名患者(97%)发生了任何级别的治疗相关不良事件(TRAE),最常见的治疗相关不良事件(TRAE)是胃肠道相关事件和疲劳。大多数TRAE为1-2级(53%),43%患者出现3-4级TRAE。总体不良反应安全可控。
JAB-21822是一种强效的、不可逆的KRAS G12C抑制剂。JAB-21822通过共价结合于KRASG12C的12位突变的半胱氨酸残基上,使KRAS G12C锁定在非活化状态,从而阻断KRAS依赖的信号转导,抑制肿瘤细胞的增殖,并诱导细胞凋亡。
2022年美国临床肿瘤学会(ASCO)年会上公布的JAB-21822一期临床数据显示,截至2022年4月1日共入组72例晚期实体瘤患者。其中有疗效评估的KRAS G12C突变的非小细胞肺癌患者共32例,客观缓解率(ORR)为56.3%(18/32),疾病控制率(DCR)为90.6%(29/32)。
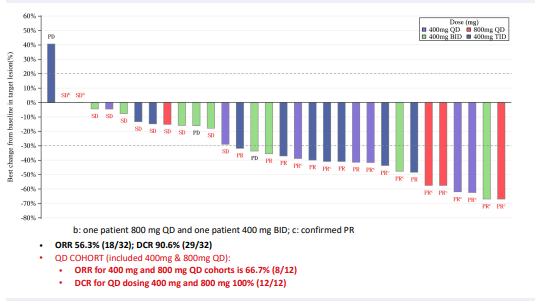
JAB-21822有良好的安全性,大部分治疗相关的不良事件为1-2级。在72例患者中,腹泻和呕吐的发生率分别为5.6%(4/72)和6.9%(5/72),无二级以上消化道不良反应。
KRAS抑制剂的研发成功给患者提供了新的选择,打破了“不可成药”的魔咒,也期待更多更优的疗效数据!目前国内有多款KRAS抑制剂临床试验也在进行中,意味着患者可以有机会免费用上这类靶向新药。我们期待更多患者获益!
*声明:本文旨在科普肿瘤医学和新药进展,任何重大医疗决策请前往正规医疗机构就诊。
*版权申明:如需转载请联系小编