今日,美国临床肿瘤学会(ASCO)年会在美国芝加哥拉开帷幕,此次采用线上线下混合会议形式,作为一年一度规模最大的临床肿瘤学会议之一,ASCO年会一直汇聚全球最新临床研究成果。近几年,KRAS抑制剂成为了其中的热点之一。
KRAS基因是实体瘤中最常见的致癌基因之一,大约30%的肿瘤患者都存在KRAS突变,其中包括90%的胰腺癌、50%的结肠癌和25%的肺癌,有13%的NSCLC患者存在KRAS-G12C突变(即12位的甘氨酸突变成半胱氨酸)。
目前全球已有2款KRAS抑制剂获批上市,分别为sotorasib和adagrasib,用于治疗至少经过一种系统性治疗失败的、携带KRAS-G12C突变的非小细胞肺癌(NSCLC)患者。
ORR达88.9%!Sotorasib联合化疗实现新突破!
Sotorasib(AMG-510)的获批是基于II期CodeBreaK 100临床试验(NCT03600883)。在2022年 AACR 大会公布了 CodeBreaK 100 研究的两年随访结果,172 例具有可评估病灶的患者的疗效分析结果表明,接受 Sotorasib治疗后,患者客观缓解率(ORR) 达 40.7%,疾病控制率(DCR )达 83.7%,中位无进展生存期(PFS )为 6.3 个月。
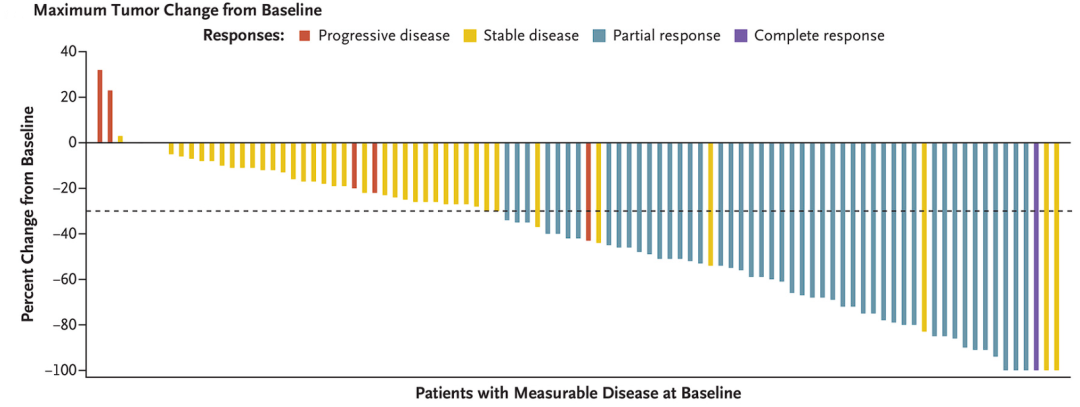
今年ASCO大会上公布Sotorasib 与卡铂-培美曲塞联合治疗 KRAS G12C 突变晚期非鳞非小细胞肺癌的单臂、Ⅱ 期研究(WJOG 14821 L)。在 2021 年 10 月至 2022 年 7 月期间,共入组30 名患者。分别对 29 例和 27 例进行安全性和有效性分析。
研究结果显示,经独立审查的 ORR 高达 88.9%(80%CI 78.5-94.8%),中位的 PFS 尚未达到,6 个月的 PFS 率为 61.2%,6 个月的 OS 率为 87%。
安全性方面,常见不良反应为贫血、中性粒细胞下降、恶心、血小板计数下降。≥3 级的不良反应主要为骨髓抑制毒性。
Sotorasib 联合化疗在 KRAS G12C 突变晚期非鳞 NSCLC 患者中表现出良好的 ORR 和耐受性。
Adagrasib(MRTX849)是一款具有高度特异性的口服KRAS G12C抑制剂,经过优化设计具有持久的靶点抑制能力。Adagrasib具有长达24小时的半衰期和广泛的组织分布,而且能够穿过血脑屏障,有助于最大限度地发挥药物效力。
Adagrasib获批,是基于一项多队列KRYSTAL-1试验的最新临床数据。
多队列KRYSTAL-1试验评估Adagrasib作为单一疗法或与其他疗法联合用于KRAS G12C突变的晚期实体瘤患者的有效性及安全性。在注册II期研究队列A中,共116名NSCLC患者接受每天两次口服600mg Adagrasib。
中位随访12.9个月,可评估疗效的112例患者客观缓解率(ORR)为43%,其中包括1例完全缓解(CR:1%)和47例部分缓解(PR:42%)。有41名患者疾病稳定(SD:37%),6名患者疾病进展(PD:5%)。疾病控制率(DCR)为80%。接近80%的患者肿瘤都有不同程度的缩小,甚至完全消失。
中位缓解持续时间(DoR)为8.5个月
中位无进展生存期(PFS)为6.5个月
中位总生存期(OS)为12.6个月
研究人员进一步评估了Adgrasib在稳定CNS转移的经治患者的疗效。颅内ORR为33%,其中包括5例CR(15%)和6例PR(18%),17例SD(52%)。DCR为85%。中位颅内PFS为5.4个月,中位颅内病灶缓解时间可达11.2个月,Adagrasib对脑转移患者同样有效。
安全性方面,与既往研究一致,未观察到新的安全信号。113名患者(97%)发生了任何级别的治疗相关不良事件(TRAE),最常见的治疗相关不良事件(TRAE)是胃肠道相关事件和疲劳。大多数TRAE为1-2级(53%),43%患者出现3-4级TRAE。总体不良反应安全可控。
随着adagrasib和sotorasib两款KRAS抑制剂的研发成功,既往亮眼的疗效数据使得国内外各大药企信心倍增,针对KRAS靶点亦是广泛布局。
JAB-21822是一种强效的、不可逆的KRAS G12C抑制剂。JAB-21822通过共价结合于KRASG12C的12位突变的半胱氨酸残基上,使KRAS G12C锁定在非活化状态,从而阻断KRAS依赖的信号转导,抑制肿瘤细胞的增殖,并诱导细胞凋亡。
JAB-21822一期临床数据显示,截至2022年4月1日共入组72例晚期实体瘤患者。其中有疗效评估的KRAS G12C突变的非小细胞肺癌患者共32例,客观缓解率(ORR)为56.3%(18/32),疾病控制率(DCR)为90.6%(29/32)。

JAB-21822有良好的安全性,大部分治疗相关的不良事件为1-2级。在72例患者中,腹泻和呕吐的发生率分别为5.6%(4/72)和6.9%(5/72),无二级以上消化道不良反应。
D-1553是国内首个自主研发并进入临床试验阶段的 KRAS G12C 抑制剂,也是国内目前公布的临床数据最多,随访时间最长的一款KRAS 抑制剂。D-1553通过共价结合,不可逆地抑制KRAS G12C,使之处于无活性的GDP结合状态。
本次ASCO公布D-1553治疗局部晚期或转移性结直肠癌的I/II期临床研究,截至2022年12月30日,纳入24例局部晚期或转移性CRC患者接受D-1553单药治疗。中位治疗时间为5.75(1.51, 11.83)个月,中位随访时间为6.64(2.46,13.11)个月。确认的ORR为20.8% (5/24)(95% Cl: 7.1%-42.2%), DCR为95.8%(23/24)。中位PFS为7.62个月(95% Cl, 2.89至9.53个月)。在数据截止日期,37.5%(9/24)的患者仍在接受研究治疗。
安全性方面,最常见(≥5%)TRAEs(任何级别)为谷丙转氨酶或天冬氨酸转氨酶升高、总胆红素或结合胆红素升高、腹泻、甲状腺功能减退和恶心。1-2级治疗相关不良事件(TRAEs)发生率为50%(12/24)。2名患者出现3/4级TRAEs(丙氨酸转氨酶升高、腹泻、高血压和低钾血症)。
D-1553在前期批露的数据中持续展现了良好的耐受性和令人期待的抗肿瘤活性,随着随访时间的增加,D-1553有望为患者实现更高的临床获益,成为中国患者人群中极具潜力的新选择。
KRAS抑制剂的研发成功给患者提供了新的选择,打破了“不可成药”的魔咒,也期待更多更优的疗效数据!目前国内有多款KRAS抑制剂临床试验也在进行中,意味着患者可以有机会免费用上这类靶向新药。我们期待更多患者获益!
*声明:本文旨在科普肿瘤医学和新药进展,任何重大医疗决策请前往正规医疗机构就诊。
*版权申明:如需转载请联系小编
在线报名