【药物信息】
重组全人源抗细胞毒T淋巴细胞相关抗原-4(CTLA-4)单克隆抗体注射液(研发代号:IBI310)
重组全人源抗程序性死亡受体-1(PD-1)单克隆抗体注射液(信迪利单抗,商品名:达伯舒®,研发代号:IBI308)
【研究设计】开放性、单臂、Ib期临床
试验方案:信迪利单抗+IBI310
1、IBI310 (CTLA-4抗体): 静脉输注,3周1次,使用4个周期
2、信迪利单抗(PD-1抗体):静脉输注,3周1次,直至疾病进展或不耐受毒性
【目标患者】经细胞学或组织学确认的经标准治疗失败或不能耐受或拒绝进行铂类标准治疗的晚期、复发或转移、无法手术的尿路上皮细胞癌患者。
【关键入排标准】1. 年龄≥18周岁且≤70周岁;
2. 经细胞学或组织学确认的经标准治疗失败或不能耐受或拒绝进行铂类标准治疗的晚期、复发或转移、无法手术的尿路上皮细胞癌;
3. 根据实体瘤疗效评价标准1.1版(RECIST v1.1),有至少1个可测量病灶;
4. 根据美国东部肿瘤协作组体力状态评分(ECOG PS评分)为0或1分;
5. 具有充分的器官和骨髓功能(首剂研究治疗前2周内使用任何细胞及生长因子治疗的受试者应除外),定义如下:
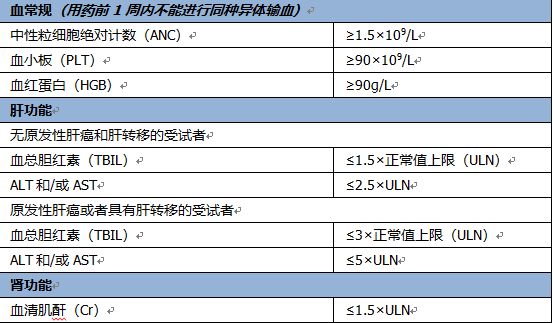
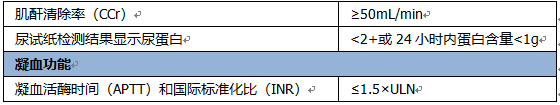
【关键排除标准】1. 既往曾暴露于任何抗CTLA-4、抗PD-1、抗PD-L1/2抗体;
2. 既往接受过全骨盆放疗;
3. 有症状的中枢神经系统转移和/或软脑脊膜转移。经过脑转移病灶治疗后症状稳定至少3个月的受试者,在首剂研究治疗之前≥4周停止糖皮质激素和抗惊厥药物治疗,且在中枢神经系统之外有可测量病灶的情况除外;
4. 已知受试者既往对其他单克隆抗体产生过严重过敏反应,或对任何IBI310制剂成分过敏;已知受试者对于任何信迪利单抗制剂成分过敏。
5. 急性或者慢性活动性乙型肝炎[定义为乙型肝炎表面抗原(HbsAg)和/或乙型肝炎核心抗体(HbcAb)阳性且乙型肝炎病毒(HBV)DNA拷贝数≥1×103拷贝数/ml或≥200 IU/ml]或急性或慢性活动性丙型肝炎病毒(HCV)抗体阳性;HCV抗体阳性但RNA检测阴性受试者允许入组;
6. 已知原发性免疫缺陷病史;
7. 已知肺结核病史;
8. 已知异体器官移植史和异体造血干细胞移植史;
9. 间质性肺病(包括既往史和现病史);
10. 临床不可控制的第三间隙积液,如入组前不能通过引流或其他方法控制的胸水和腹水;
11. 即使给予规范治疗仍然未受控制的动脉高血压(收缩压≥160 mmHg或舒张压≥100 mmHg)。
报名微信:17898858853
在线报名