2023年3月29日,Claudin18.2单抗TST001获得了FDA授予的胰腺癌孤儿药资格认证。此前,TST001已经获得FDA授予的胃癌孤儿药资格认证。在2022年ESMO大会上公布的TST001联合卡培他滨和奥沙利铂(CAPOX)用于Claudin18.2阳性胃癌及胃食管连接部癌患者一线治疗数据,展现了良好的耐受性和令人鼓舞的抗肿瘤活性,疾病控制率达100%。
CLDN18.2是一种在正常胃细胞中发现的跨膜蛋白,是控制细胞间分子流动的上皮和内皮紧密连接的主要成分。CLDN18.2属于CLDNs家族成员,属于CLDNs18的亚型,它是一种CD20样分化的蛋白,在多种肿瘤组织中高度表达,比如胃癌(60%~80%)、胰腺癌(50%)、食管癌(30%~50%)和肺癌(40%~60%)等,但是在正常组织中几乎没有表达,因而具有出色的治疗潜力。
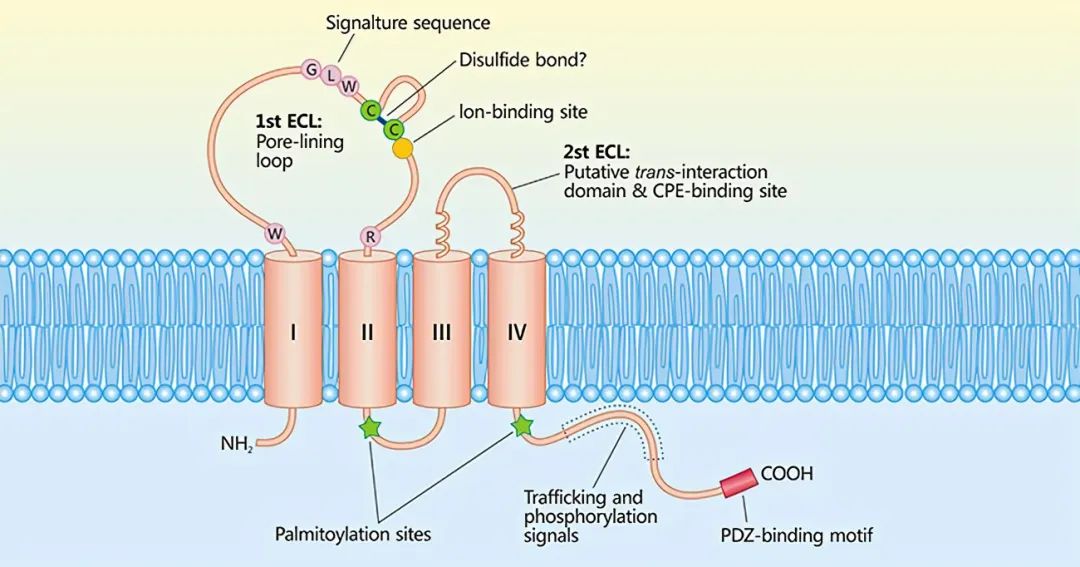
因该靶点在正常组织中的高度特异性,再加上在多种癌症中的激活表达,使得Claudin18.2蛋白成为了研究人员开发胃癌、胰腺癌等实体瘤免疫疗法的理想靶点。
Claudin18.2被寄予厚望,研发热度越来越高。
Zolbetuximab是全球首款靶向Claudin 18.2的克隆抗体。2022年11月17日,安斯泰来宣布其Claudin18.2(CLDN18.2)抗体Zolbetuximab联合mFOLFOX6(一种包括奥沙利铂、亚叶酸钙和氟尿嘧啶的药物联合方案)一线治疗Claudin18.2阳性、HER2阴性的复发性转移性胃癌的三期临床SPOTLIGHT试验达到主要终点。
TST001是一种高亲和力的靶向Claudin18.2的人源化单克隆抗体,通过抗体依赖性细胞毒性(ADCC)和补体依赖性细胞毒性(CDC)机制杀死表达Claudin18.2的肿瘤细胞,具有增强的ADCC和CDC活性,在异种移植试验中显示出强大的抗肿瘤活性。该药物是全球第二个Claudin18.2靶向抗体治疗药物。
Zolbetuximab针对的是Claudin18.2高表达患者,而这一部分患者占比较小。TST001通过降低岩藻糖修饰,以及更高的亲和力,最终抗肿瘤活性优于Zolbetuximab,对Claudin18.2中表达和高表达的人群同样有效,适用范围明显扩大。
此前TST001在2022 年ESMO大会上亮相的1/2期临床试验表现出较好的疗效和安全性。
研究显示,截至2022年8月4日,共有51例患者入组并接受了TST001治疗,其中包括在扩展阶段(中位随访时间为65天)以6mg/kg剂量三周给药一次接受TST001联合CAPOX治疗的36例患者。有可测量病灶且至少有过一次治疗后肿瘤评估的15例患者中,有11例获得部分缓解,客观缓解率(ORR)为73.3%,有4例(26.7%)达到疾病稳定,疾病控制率(DCR)达100%。其中,8名Claudin18.2中/高表达及5名Claudin18.2未知表达的患者中,分别有6名和5名患者取得了部分缓解。
研究中所有入组的患者都接受了安全性和耐受性评估。治疗中出现的不良事件(无论有无因果关系)大多为1-2级,包括恶心、低白蛋白血症、贫血、呕吐、血小板计数降低。治疗中出现的不良事件,12例(23.5%)患者延迟给药,5例(9.8%)患者剂量降低,无患者停药。
TST001在表达Claudin18.2的未接受治疗胃癌患者中显示出可控的安全性及令人鼓舞的抗肿瘤活性。我们期待此研究进一步的疗效数据,为Claudin18.2阳性患者提供新的治疗选择。
Claudin18.2靶点作为肿瘤治疗领域下一代非常有潜力的靶点,成为各方角逐的重点。国内已有多款claudin18.2产品正在开展,如TST001,、MIL93、QLS31905等,虽然目前国内没有针对此靶点获批上市的药物,我们相信随着临床试验的开展,靶向Claudin18.2新药或新疗法将会取得更大的突破!
*声明:本文旨在科普肿瘤医学和新药进展,任何重大医疗决策请前往正规医疗机构就诊。
*版权申明:如需转载请联系小编
在线报名