前不久,美国FDA批准口服KRAS G12C抑制剂adagrasib(MRTX849)上市,用于治疗至少接受过一种先前全身性疗法的KRAS G12C突变非小细胞肺癌(NSCLC)患者。这是继Lumakras(sotorasib)之后全球上市的第2款KRAS G12C抑制剂。此前,该产品获FDA授予突破性疗法资格认定。

KRAS基因是实体瘤中最常见的致癌基因之一,曾被认为是“不可成药”的难治靶点。大约30%的肿瘤患者都存在KRAS突变,其中包括90%的胰腺癌、50%的结肠癌和25%的肺癌。全球约有13%的NSCLC患者存在KRAS-G12C突变(即12位的甘氨酸突变成半胱氨酸),在中国所有的肿瘤患者中KRAS-G12C突变率大概2-3%。这一突变类型治疗比较困难,对许多常用的治疗方案并不敏感,总体预后较差。
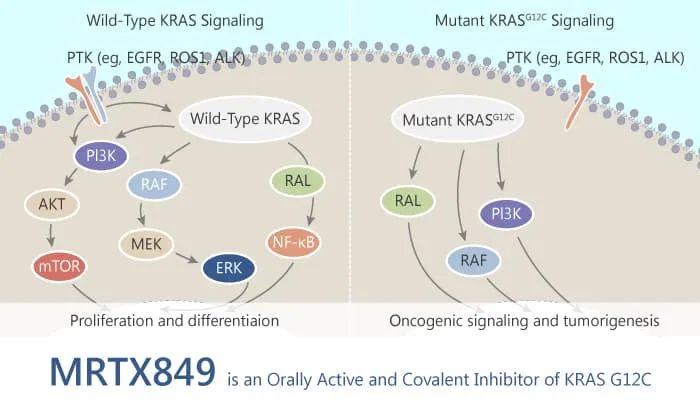
虽然KRAS的致癌原理早在1981年就已阐明,但由于 KRAS蛋白体积小,表面光滑——就像一个闪亮光滑的球,蛋白质结构缺乏传统的小分子药物可结合的“深囊”结构。此外,激活状态下, GTP与 KRAS紧密结合,增加了抑制 KRAS激活的难度。因此,在过去40年都没有靶向KRAS新药问世。
随着adagrasib和sotorasib两款KRAS抑制剂的研发成功,亮眼的疗效数据使得国内外各大药企信心倍增,针对KRAS靶点亦是广泛布局。
Adagrasib是一款具有高度特异性的口服KRAS G12C抑制剂,经过优化设计具有持久的靶点抑制能力。Adagrasib具有长达24小时的半衰期和广泛的组织分布,而且能够穿过血脑屏障,有助于最大限度地发挥药物效力。
此次Adagrasib获批,是基于一项多队列KRYSTAL-1试验的最新临床数据。
多队列KRYSTAL-1试验评估Adagrasib作为单一疗法或与其他疗法联合用于KRAS G12C突变的晚期实体瘤患者的有效性及安全性。在注册II期研究队列A中,116名先前接受过铂类化疗和抗PD-1/L1治疗的NSCLC患者每天两次口服600mg Adagrasib。研究人员旨在评估客观缓解率(ORR)、疾病控制时间(DCR)、无进展生存期(PFS)、总生存(OS)和安全性。
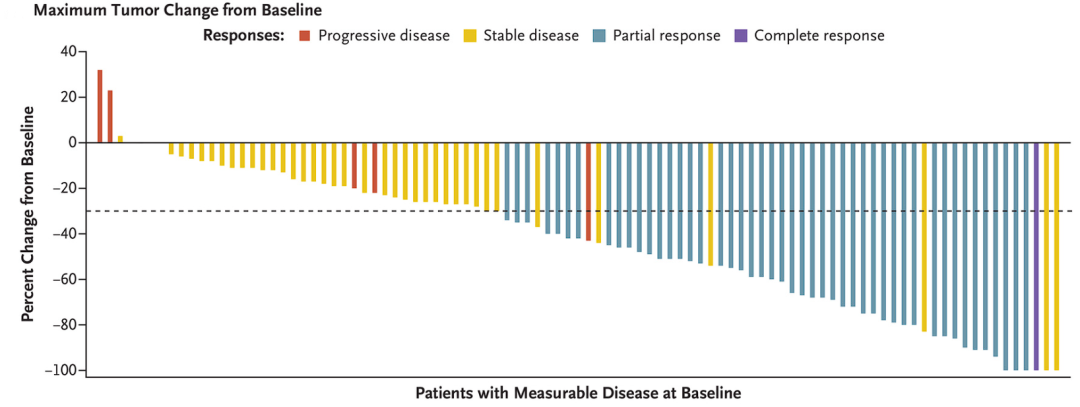
中位随访12.9个月,可评估疗效的112例患者客观缓解率(ORR)为43%,其中包括1例完全缓解(CR:1%)和47例部分缓解(PR:42%)。有41名患者疾病稳定(SD:37%),6名患者疾病进展(PD:5%)。疾病控制率(DCR)为80%。接近80%的患者肿瘤都有不同程度的缩小,甚至完全消失。
中位缓解持续时间(DoR)为8.5个月。数据截止时,有一半应答者(n=24)正在进行治疗,33%(n=16)的患者保持治疗反应。
中位无进展生存期(PFS)为6.5个月,6个月和12个月PFS率分别为52%和29%。
中位总生存期(OS)为12.6个月,6个月和12个月OS率分别为71%和51%。
研究人员进一步评估了Adgrasib在稳定CNS转移的经治患者的疗效。颅内ORR为33%,其中包括5例CR(15%)和6例PR(18%),17例SD(52%)。DCR为85%。中位颅内PFS为5.4个月,中位颅内病灶缓解时间可达11.2个月,Adagrasib对脑转移患者同样有效。
与既往研究一致,未观察到新的安全信号。113名患者(97%)发生了任何级别的治疗相关不良事件(TRAE),最常见的治疗相关不良事件(TRAE)是胃肠道相关事件和疲劳。大多数TRAE为1-2级(53%),43%患者出现3-4级TRAE。总体不良反应安全可控。
KRAS抑制剂的研发成功给患者提供了新的选择,也期待更多更优的疗效数据!
目前,Adagrasib正同步在国内开展临床试验,加快在中国的上市步伐。
此外,国内有多款KRAS抑制剂临床试验也在进行中,意味着患者可以有机会免费用上这类靶向新药。我们期待更多患者获益!
*声明:本文旨在科普肿瘤医学和新药进展,任何重大医疗决策请前往正规医疗机构就诊。
*版权申明:如需转载请联系小编
在线报名